An English version follows
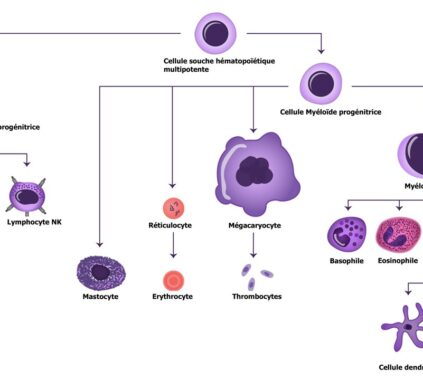
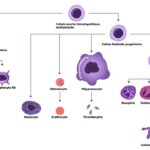
À travers la génotoxicité, il a été montré in vitro que les pesticides pouvaient endommager l’ADN (Rojas et al., 2009). Une étude indique que des modifications géniques et épigénétiques, telles que des mutations entraînant une instabilité génétique ou une suppression de l’apoptose des cellules germinales, peuvent être transmises à partir du père dans le fluide séminal et justifie ainsi l’impact de l’exposition paternelle dans l’apparition des pathologies sur le développement in utero de l’enfant, mais également de son système endocrinien et reproductif (Cordier, 2008). Ainsi, grâce à un modèle de souris dont la couleur du pelage varie en réponse à des modifications de la méthylation de l’ADN, ont été mis en évidence au niveau du génome de la descendance de femelles exposées au Bisphénol A durant la gestation et la lactation (Dolinoy et al., 2007). Les perturbateurs endocriniens interfèrent avec le processus normal de méthylation de l’ADN et conduisent à des anomalies de l’expression des gènes associés aux fonctions de reproduction qui seront transmises aux générations futures (WWF, 2011). Les cellules germinales/souches contiennent l’ADN qui est transmis de génération en génération. Nous savons que les mutations de l’ADN sont héréditaires et peuvent entraîner des maladies héréditaires, mais ce n’est pas ainsi que les perturbateurs hormonaux agissent. D’autres types de changements héréditaires peuvent être programmés dans l’ADN: il s’agit de changements épigénétiques, définis comme des modifications de l’ADN (mais pas des mutations) qui modifient la façon dont l’ADN est régulé et transformé en protéines. Cela signifie que ces changements peuvent être hérités sur une ou plusieurs générations. Il a été démontré que les perturbateurs endocriniens causent plusieurs types de modifications épigénétiques dans les cellules germinales qui, chez la progéniture (enfants) issue du sperme ou des ovules, entraînent une propension accrue aux troubles endocriniens et neurologiques chez la génération suivante (petits-enfants) (Walker et Gore, 2017). Ainsi, les expositions aux perturbateurs hormonaux avant la conception ou au début de la vie influencent plusieurs générations. Le cycle de l’exposition ne s’arrête pas aux petits-enfants. Certaines modifications épigénétiques des cellules germinales causées par les perturbateurs endocriniens sont permanentes et héréditaires pour les arrière-petits-enfants, les arrière arrière-petits-enfants, et au-delà. En effet, cela a été démontré pour la première fois dans une étude expérimentale sur le rat utilisant le fongicide vinclozoline contenant des perturbateurs hormonaux, dans lequel la transmission de la propension à la maladie (anomalies reproductives et hormonales) a été observé jusqu’à 4 générations après l’exposition initiale (Anway et al., 2005). Cette étude a mis en évidence un mécanisme épigénétique pour la transmission de cette maladie. Depuis lors, de nombreuses études menées sur les animaux ont montré que de nombreux produits chimiques avaient des effets épigénétiques sur plusieurs générations (Walker et Gore, 2011), y compris les produits chimiques contenus dans les plastiques, et qu’ils étaient associés à des problèmes reproductifs et endocriniens (Manikkam et al., 2013 ; Rattan et al., 2018).
Through genotoxicity, it has been shown in vitro that pesticides can damage DNA (Rojas et al., 2009). One study indicates that gene and epigenetic modifications, such as mutations leading to genetic instability or suppression of germ cell apoptosis, can be transmitted from the father in seminal fluid, thus justifying the impact of paternal exposure in the appearance of pathologies on the child’s in utero development, as well as its endocrine and reproductive systems (Cordier, 2008). For example, using a mouse model in which coat colour varies in response to changes in DNA methylation, the genome of the offspring of females exposed to bisphenol A during gestation and lactation has been shown to be affected (Dolinoy et al., 2007). Endocrine disruptors interfere with the normal process of DNA methylation and lead to abnormalities in the expression of genes associated with reproductive functions that will be passed on to future generations (WWF, 2011). The germ/stem cells contain the DNA that is passed on from generation to generation. We know that DNA mutations are inherited and can lead to hereditary diseases, but this is not how hormone disruptors work. Other types of heritable changes can be programmed into DNA: these are epigenetic changes, defined as modifications to DNA (but not mutations) that alter the way DNA is regulated and transformed into proteins. This means that these changes can be inherited over one or more generations. Endocrine disruptors have been shown to cause several types of epigenetic changes in germ cells that, in offspring (children) derived from sperm or eggs, lead to an increased propensity for endocrine and neurological disorders in the next generation (grandchildren) (Walker and Gore, 2017). Thus, exposure to hormone disruptors before conception or early in life influences several generations. The cycle of exposure does not stop with the grandchildren. Certain epigenetic changes in germ cells caused by endocrine disruptors are permanent and heritable for great-grandchildren, great-great-grandchildren and beyond. Indeed, this was demonstrated for the first time in an experimental study on rats using the hormone-disrupting fungicide vinclozolin, in which the transmission of disease propensity (reproductive and hormonal abnormalities) was observed up to 4 generations after initial exposure (Anway et al., 2005). This study highlighted an epigenetic mechanism for the transmission of this disease. Since then, numerous animal studies have shown that many chemicals have multigenerational epigenetic effects (Walker and Gore, 2011), including chemicals in plastics, and that they are associated with reproductive and endocrine problems (Manikkam et al., 2013; Rattan et al., 2018).
Références
Anway, M. D., Cupp, A. S., Uzumcu, M., et Skinner, M. K. (2005). Epigenetic transgenerational actions of endocrine disruptors and male fertility. Science (New York, NY)., 308(5727), 1466–1469. https://doi.org/10.1126/science.1108190
Cordier, S. (2008). Evidence for a role of paternal exposures in developmental toxicity. Basic Clin Pharmacol Toxicol, 102(2), 176–181. https://doi.org/10.1111/j.1742-7843.2007.00162.x
Dolinoy, D. C., Huang, D., et Jirtle, R. L. (2007). Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development. Proc Natl Acad Sci U S A, 104, 13056-13061. https://doi.org/10.1073/pnas.0703739104
Manikkam, M., Tracey, R., et Guerrero-Bosagna, C. Skinner, M. K. (2013). Plastics derived endocrine disruptors (BPA, DEHP and DBP) induce epigenetic transgenerational inheritance of obesity, reproductive disease and sperm epimutations. PloS One, 8(1), e55387. https://doi.org/10.1371/journal.pone.0055387
Rattan, S., Brehm, E., Gao, L., et Flaws, J. A. (2018). Di(2-ethylhexyl) phthalate exposure during prenatal development causes adverse transgenerational effects on female fertility in mice. Toxicological Sciences : An Official Journal of the Society of Toxicology. https://doi.org/10.1093/toxsci/kfy042
Rojas, U. Ojeda, M.E. et Barraza, X. (2009). Congenital malformations and pesticides exposures. Rev Med Chil, 128(4), 399–404.
Walker, D. M., et A.C., G. (2011). Transgenerational neuroendocrine disruption of reproduction. Nature Reviews Endocrinology., 7(4), 197–207. https://doi.org/10.1038/nrendo.2010.215
Walker, D. M., et Gore, A. C. (2017). Epigenetic impacts of endocrine disruptors in the brain. Front Neuroendocrinol., 44, 1–26. https://doi.org/10.1016/j.yfrne.2016.09.002
World Wildlife Fund. (2011). Perturbateurs endocriniens & biodiversité La diversité biologique face au risque chimique : nécessité d ’ un changement de paradigme 32 p.
Afrique Afrique de l'Ouest Burkina Faso Cancer Endocriniens Hormones Mutagène Perturbateurs
Last modified: 12 octobre 2023